Geschichte der Physik: Strahlung, Welle und Teilchen
Licht und Strahlung
Vor über 2300 Jahren wussten die alten Griechen, dass das Licht in geraden Linien verläuft und die Römer benutzten wassergefüllte Glaskugeln, um Objekte zu vergrößern. Aber erst im 13. Jahrhundert wurden Glaslinsen für Brillen hergestellt. Das Teleskop wurde in den frühen 1600er Jahren erfunden. Im selben Jahrhundert entdeckte Snell das Brechungsgesetz, Huyghens schlug vor, dass Licht eine Form von Wellenbewegung sei und Isaac Newton demonstrierte, dass weißes Licht eine Mischung von Farben ist. Newton versuchte auch, die Natur des Lichts zu erklären. Er dachte, dass das Licht aus Millionen winziger "Korpuskeln" (Teilchen) besteht.
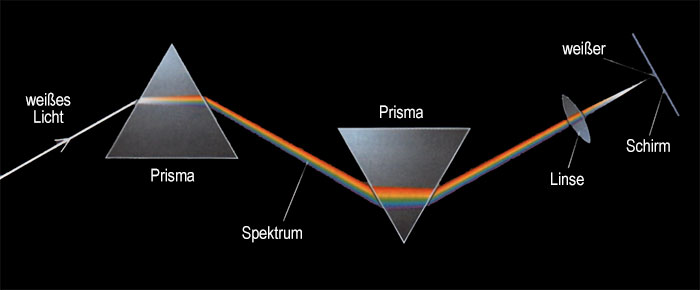
In den frühen 1800er Jahren untersuchte Thomas Young die Interferenz und Beugung von Licht und nutzte erfolgreich die Wellentheorie, um diese Effekte zu erklären. Aus seinen Ergebnissen konnte er auch einen Wert für die Wellenlänge des Lichts berechnen. Youngs Arbeit schien Newtons "Korpuskeln" ein Ende bereitet zu haben, aber diese sollten später in einer anderen Form in der Wissenschaft wieder auftauchen. Einige Materialien geben Elektronen ab, wenn sie Licht absorbieren. Dies wird als photoelektrischer Effekt bezeichnet. Im Jahr 1905 war Albert Einstein in der Lage, dies zu erklären, indem er annahm, dass Licht aus partikelartigen Ausbrüchen von Wellenenergie bestand, die als Photonen bezeichnet wurden. Licht, so schien es, konnte sich gleichzeitig wie eine Welle und wie ein Teilchen verhalten.

James Clerk Maxwell war der erste, der die Idee vortrug, dass Licht eine Art elektromagnetische Strahlung sei. Das war im Jahre 1864. Aus seiner theoretischen Arbeit über elektrische und magnetische Felder sagte er die Existenz von elektromagnetischen Wellen voraus, berechnete ihre Geschwindigkeit und fand heraus, dass sie genau der Lichtgeschwindigkeit entsprach. Seine Gleichungen sagten auch die Existenz von Radiowellen voraus, obwohl "echte" Radiowellen erst in den 1880er Jahren entdeckt wurden. Röntgenstrahlen wurden von Wilhelm Röntgen im Jahre 1895 entdeckt, aber ihre elektromagnetische Natur wurde erst 1912 festgestellt.
Im Jahr 1896 entdeckte Henri Becquerel eine Strahlung, ausgehend von Uransalzen, die durch Objekte durchdrang. Er hatte die Radioaktivität entdeckt. Später zeigte Marie Curie, dass die Strahlung von innerhalb des Atoms kam und nicht auf Reaktionen mit anderen Stoffen zurückzuführen war. Im Jahr 1899 untersuchte Ernest Rutherford die Radioaktivität und identifizierte zwei Arten von Strahlung, die er Alpha und Beta nannte. Im folgenden Jahr entdeckte er die Gammastrahlung. Heute wissen wir, dass sich Wellen wie die Gammastrahlung wie Teilchen verhalten können und dass sich Teilchen auch wie Wellen verhalten können. Wissenschaftler nennen dies Welle-Teilchen-Dualismus.
Atome und Elektronen
Das Wort "Atom" kommt aus dem griechischen (Atomos) und bedeutet "unteilbar". Die erste moderne Verwendung des Wortes wird John Dalton zugeschrieben, der 1803 seine Atomtheorie vorbrachte, um die Regeln zu erklären, die die Proportionen bestimmen, in denen verschiedene Elemente chemisch kombiniert werden. Dalton vermutete, dass alle Materie aus winzigen Teilchen bestand, die man Atome nannte. Jedes Element hatte seinen eigenen Typ von Atomen und Atome desselben Elements waren identisch. Atome konnten weder geschaffen noch zerstört werden, noch konnten sie in kleinere Teile zerlegt werden.

Aber aus was bestanden die Atome? Die ersten Hinweise kamen in den 1890er Jahren, als Wissenschaftler die Leitung von Elektrizität durch Gase untersuchten. Sie fanden heraus, dass Atome unsichtbare, negativ geladene Strahlen abgeben konnten. J. J. Thomson untersuchte die Strahlen und leitete daraus ab, dass es sich um Teilchen handelt, die viel leichter sind als Atome. Das war 1897. Thomson hatte das Elektron entdeckt.
Wenn ein Atom negativ geladene Elektronen enthält, muss es auch etwas mit einer positiven Ladung geben, um es elektrisch neutral zu halten. Aber wo war diese Ladung? 1911 bestrahlte ein Team um Ernest Rutherford eine dünne Goldfolie mit Alphateilchen. Die Wissenschaftler fanden heraus, dass die meisten Alphateilchen geradlinig durch die Goldfolie hindurchgingen, aber einige wurden in einem großen Winkel abgelenkt. Um dies zu erklären, schlug Rutherford vor, dass jedes Atom weitgehend aus leerem Raum besteht und die positive Ladung und der größte Teil seiner Masse in einem winzigen Kern konzentriert sind.
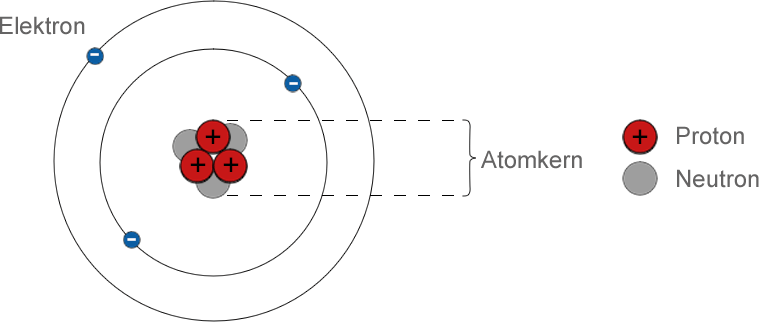
In Rutherfords Modell (Bild) des Atoms umkreisen Elektronen den Kern wie Planeten die Sonne. Unglücklicherweise hatte das Modell einen schwerwiegenden Fehler: Nach der klassischen Theorie sollte ein umkreisendes Elektron kontinuierlich Energie aussenden und spiralförmig in den Kern stürzen, so dass seine Umlaufbahn nicht stabil sein konnte. Im Jahr 1913 nutzte Niels Bohr die Quantentheorie, um dieses Problem zu lösen. Nach Bohr bewegten sich die Elektronen in festen Bahnen und konnten nicht kontinuierlich strahlen. Sie konnten nur Energie verlieren, indem sie auf eine niedrigere Umlaufbahn springen und ein Quantum ("Paket") elektromagnetischer Energie emittieren - mit anderen Worten, ein Photon. Mit diesem Modell konnte Bohr die Positionen der Linien im Wasserstoffspektrum vorhersagen. Seine Berechnungen funktionierten jedoch nicht für Elemente mit einer komplizierteren Elektronenstruktur. Um dieses Problem zu lösen, entwickelten die Wissenschaftler später ein mathematisches, wellenmechanisches Modell des Atoms.

Das Rutherford-Bohr-Modell des Atoms sagte nichts darüber aus, was sich in dessen Kern befand. Im Jahr 1919 verwendete Rutherford jedoch Alpha-Teilchen, um positiv geladene Teilchen aus dem Kern zu schießen. Das waren die Protonen. Im Jahr 1932 entdeckte James Chadwick, dass der Kern auch Neutronen enthielt. In den letzten Jahren haben Experimente mit Teilchenbeschleunigern gezeigt, dass Protonen und Neutronen wiederum aus Teilchen bestehen, die als Quarks bezeichnet werden.